
138-2654-2846

美国食品药品监督管理局(FDA)早在今年(2020年)2月初就为了应对各类医疗器械的紧缺,发布了各类EUA(应急使用授权),在今年3月27号发布了个人防护设备的EUA认证。
包括:呼吸机EUA认证;个人防护装备EUA认证;体外诊断EUA认证;
发布时间及适用产品
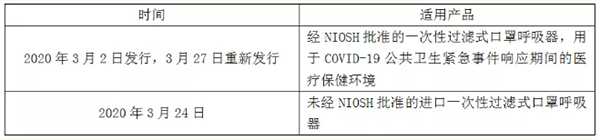
注:EUA授权的口罩均不用于个人,只能是医护人员。

EUA申请流程
1.递交申请(附相关资料);
2.FDA根据产品类型提交需要注册的资料清单;
3.企业按要求递交相关资料;
4.FDA对其进行审批;
5.企业根据要求进行整改;
6.FDA最终做出决定
EUA认可标准和证书
产品面向医用市场
则产品满足以下标准或者认证即可
欧盟CE认证
澳大利亚ARTG
加拿大Health Canada Licence
日本PMDA/MHLW
或以下相关标准:
Australia AS/NZS 1716:2012 P3,P2
Brazil ABNT/NBR 13698:2011 PFF3,PFF2
Europe EN 149-2001 FFP3,FFP2
Japan JMHLW-2000 DS/DL3 DS/DL2
或者直接获得美国NIOSH认证(限以下三种类型)
1.无动力空气净化颗粒FFR和可重复使用的呼吸器,例如,NIOSH根据42 CFR Rart 84批准并列于NIOSH认证设备清单(CEL)中的无动力空气净化器 具有颗粒防护的呼吸器;
2.经NIOSH批准的其他电动空气净化呼吸器(PAPR),符合42 CFR第84部分的规定,并列在NIOSH CEL上的具有颗粒防护的PAPR上;
3.经NIOSH批准但已通过制造商建议的保质期的FFR,未损坏,并且已由制造商按照HCP的要求在制造商的医疗场所使用。
产品面向个人市场,则产品应获得NIOSH认证
CDC优化呼吸器供应策略中推荐的NIOSH替代标准,除了国内标准:GB 2626-2006外,其他均被EUA采纳。即使中国标准口罩被认为可以提供给个人使用,但目前必须再通过NIOSH认证。